Ковалентний зв'язок утворюється при взаємодії неметалічних елементів. Атоми неметалічних елементів мають високу електронегативність і намагаються заповнити зовнішній електронний шар за рахунок чужих електронів. Два таких атома можуть перейти в стійкий стан, якщо об'єднають свої електрони.
Ковалентний зв'язок — це зв'язок між атомами неметалічних елементів, він утворюється за рахунок спільних електронних пар.
Розглянемо виникнення ковалентного зв'язку в простих речовинах.
1. Утворення молекули водню.
Кожен атом Гідрогену має один електрон. Для переходу в стійкий стан йому необхідний ще один електрон.
При зближенні двох атомів електронні хмари перекриваються. Утворюється спільна електронна пара, яка зв'язує атоми Гідрогену в молекулу.
У просторі між двома ядрами спільні електрони бувають частіше, ніж в інших місцях. Там формується область з підвищеною електронною густиною і негативним зарядом. Позитивно заряджені ядра притягуються до неї, і утворюється молекула.
При цьому кожен атом отримує завершений зовнішній рівень, що містить два електрони і переходить у стійкий стан.
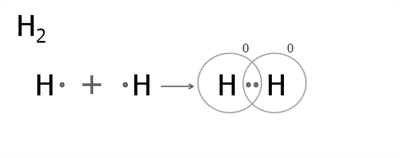
Ковалентний зв'язок з утворенням однієї спільної електронної пари називається одинарним.
Спільні електронні пари (ковалентні зв'язки) утворюються за рахунок неспарених електронів, розташованих на зовнішніх енергетичних рівнях атомів, що взаємодіють.
У Гідрогену — один неспарений електрон. Для інших елементів їх число дорівнює різниці «8 – №» групи.
Неметали VIIА групи (галогени) мають на зовнішньому шарі один неспарений електрон.
У неметалів VIА групи (Оксиген, Сульфур) таких електронів два.
У неметалів VА групи (Нітроген, Фосфор) — три неспарених електрони.
2. Утворення молекули фтору.
Атом Флуору на зовнішньому рівні має сім електронів. Шість з них утворюють пари, а сьомий — неспарений.
При сполученні атомів утворюється одна спільна електронна пара, тобто виникає один ковалентний зв'язок. Кожен атом отримує завершений восьмиелектронний зовнішній шар. Зв'язок у молекулі фтору — одинарний. Такі ж одинарні зв'язки існують в молекулах хлору, брому та йоду.
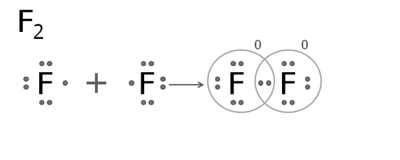
Якщо атоми мають кілька неспарених електронів, то утворюються дві або три спільні пари.
3. Утворення молекули кисню.
В атомі Оксигену на зовнішньому рівні — два неспарених електрона.
При взаємодії двох атомів Оксигену виникають дві спільні електронні пари. Кожен атом заповнює свій зовнішній рівень до восьми електронів. Зв'язок в молекулі кисню — подвійний.
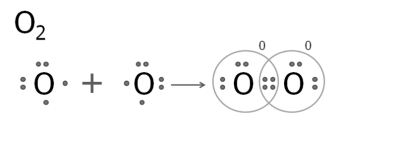
4. Утворення молекули азоту.
Атом Нітрогену має три неспарених електрони на зовнішньому рівні.
У молекулі утворюються три спільні електронні пари. Зв'язок в молекулі азоту — потрійний.
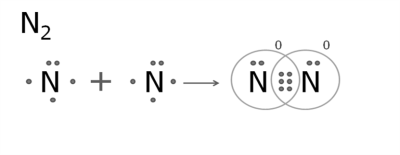
Утворення ковалентних зв'язків показують структурні (графічні) формули, в яких спільна електронна пара позначається рискою. Одна риска між атомами позначає одинарний зв'язок, дві риски — подвійний, три риски — потрійний:
;
.