З \(118\) відомих на даний момент хімічних елементів \(22\) елементи утворюють прості речовини, що володіють неметалічними властивостями. Неметалічних простих речовин набагато більше, ніж самих неметалічних хімічних елементів. Причиною тому є алотропія.
Алотропія — це здатність атомів даного хімічного елемента утворювати декілька простих речовин, які називаються алотропними видозмінами або алотропними модифікаціями.
Наприклад, хімічний елемент Оксиген \(O\) утворює просту речовину кисень , молекула якого складається з двох атомів, і просту речовину озон , молекула якого складається з трьох атомів даного елемента.
Хімічний елемент Фосфор \(P\) утворює безліч алотропних видозмін, найважливішими з яких є червоний фосфор і білий фосфор.
Хімічний елемент Карбон \(C\) утворюе модифікації що зустрічаються у природі — алмаз і графіт.
Алотропні видозміни, утворені одним і тим самим хімічним елементом, істотно відрізняються між собою як за будовою, так і за властивостями.
Алотропія властива не всім неметалічним хімічним елементам.
Наприклад, Гідроген, Нітроген, елементи \(VIIA\) і \(VIIIA\) груп не мають алотропних модифікацій, тобто кожен із цих елементів утворює лише одну просту речовину.
Кристалічна ґратка неметалів
Причиною великої різноманітності фізичних властивостей неметалів є різна будова кристалічних ґраток цих речовин.
Частина неметалів має атомну кристалічну ґратку. Кристали таких речовин складаються з атомів, сполучених між собою міцними ковалентними зв'язками. Такі неметали є у твердому агрегатному стані і є нелеткими. Прикладами таких речовин є алмаз, графіт, червоний фосфор і силіцій.
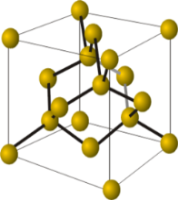
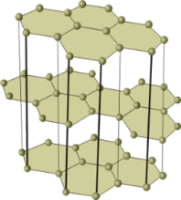
Моделі кристалічних ґраток алмазу (зліва) і графіту.
Кристали алмазу і графіту — алотропних видозмін, складаються з атомів Карбону, сполучених між собою ковалентними зв'язками. Кристали графіту, на відміну від кристалів алмазу, утворюються з окремих шарів, які розташовуються один по відношенню до одного подібно до того, як аркуші паперу в книжці.
Інша частина неметалів має молекулярну кристалічну ґратку. В цьому випадку в кожній молекулі атоми сполучені досить міцними ковалентними зв'язками, а ось окремі молекули одна з одною в кристалах речовини пов'язані дуже слабо. Тому речовини молекулярної будови при звичайних умовах можуть бути газами, рідинами або легкоплавкими твердими речовинами.
Кисень , озон , азот , водень , фтор , хлор , бром , йод , білий фосфор , кристалічна сірка і інертні гази — це все речовини, кристали яких складаються з окремих молекул (а у випадку інертних газів — з окремих атомів, які виконують роль молекул).
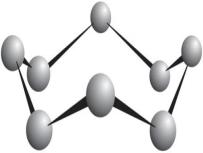

Модель молекули сірки (зліва) і кристал сірки. Кристал сірки складається з окремих молекул \(S_8\)