Більшість твердих речовин має кристалічну будову, яка характеризується чітким розташуванням частинок. Якщо з'єднати частинки умовними лініями, то вийде просторовий каркас, який називають кристалічною ґраткою. Точки, в яких розміщені частинки кристалу, називають вузлами ґратки. У вузлах уявної ґратки можуть перебувати атоми, йони або молекули.
Залежно від природи частинок, розташованих у вузлах, і характеру зв'язку між ними, розрізняють чотири типи кристалічних ґраток: йонну, металічну, атомну і молекулярну.
Йонними називають ґратки, у вузлах яких містяться йони.
Йонні ґратки утворюють речовини з йонним зв'язком. У вузлах таких ґраток розташовуються позитивно і негативно заряджені йони, зв'язані між собою електростатичною взаємодією.
Йонні кристалічні ґратки мають солі, луги, оксиди активних металів. Йони можуть бути простими чи складними. Наприклад, у вузлах кристалічної ґратки натрій хлориду містяться прості йони Натрію і Хлору , а у вузлах ґратки калій сульфату чергуються прості йони Калію і складні сульфат-йони .
Зв'язки між йонами у таких кристалах є міцними. Тому йонні речовини є твердими, тугоплавкими, нелеткими. Такі речовини добре розчиняються у воді.
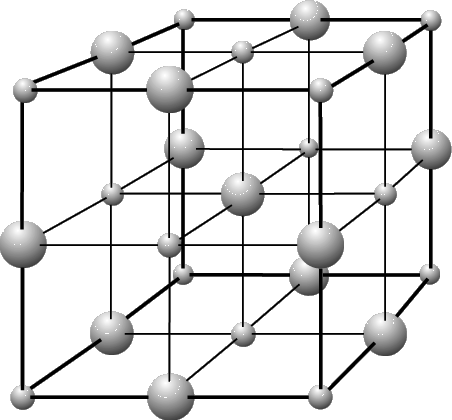
Кристалічна ґратка натрій хлориду

Кристал натрій хлориду
Металічними називають ґратки, які складаються з позитивних йонів, атомів металу і вільних електронів.
Металічні ґратки утворюють речовини з металічним зв'язком. У вузлах металічної ґратки містяться атоми і йони (то атоми, то йони, в які легко перетворюються атоми, віддаючи свої валентні електрони у загальне користування).
Такі кристалічні ґратки є характерними для простих речовин металів і сплавів.
Температури плавлення металів можуть бути різними (від \(–37\) °С у ртуті до двох-трьох тисяч градусів). Але всі метали мають характерний металічний блиск, ковкість, пластичність, добре проводять електричний струм і тепло.
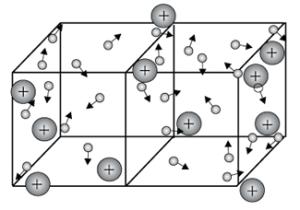
Металічна кристалічна ґратка

Металічні вироби
Атомними називають кристалічні ґратки, у вузлах яких містяться окремі атоми, зв'язані ковалентними зв'язками.
Атомний тип ґратки має алмаз — одна з алотропних видозмін Карбону. До речовин з атомною кристалічною ґраткою належать графіт, силіцій, бор, германій, а також складні речовини, наприклад, карборунд , кремнезем, кварц, гірський кришталь, пісок, до складу яких входить силіцій(\(IV\)) оксид .
Таким речовинам притаманні висока міцність і твердість. Так, алмаз є найтвердішою природною речовиною. У речовин з атомною кристалічною ґраткою дуже високі температури плавлення і кипіння. Наприклад, температура плавлення кремнезему — \(1728\) °С, а у графіту вона ще вище — \(4000\) °С. Атомні кристали практично нерозчинні у воді.
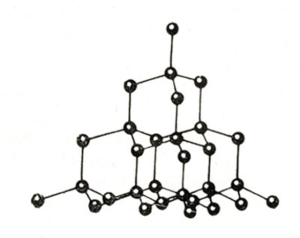
Кристалічна ґратка алмазу

Алмаз
Молекулярними називають ґратки, у вузлах яких містяться молекули, зв'язані слабкою міжмолекулярною взаємодією.
Незважаючи на те, що всередині молекул атоми сполучені дуже міцними ковалентними зв'язками, між самими молекулами діють слабкі сили міжмолекулярної взаємодії. Тому молекулярні кристали мають невелику міцність і твердість, низькі температури плавлення і кипіння. Багато молекулярних речовин при кімнатній температурі є рідинами і газами. Такі речовини — леткі. Наприклад, кристалічні йод і твердий карбон(\(IV\)) оксид («сухий лід») випаровуються, не переходячи у рідкий стан. Деякі молекулярні речовини мають запах.
Такий тип ґратки мають прості речовини у твердому агрегатному стані: благородні гази з одноатомними молекулами (), а також неметали з двох— і багатоатомними молекулами ().
Молекулярну кристалічну ґратку мають також речовини з ковалентними полярними зв'язками: вода — лід, твердий амоніак, кислоти, оксиди неметалів. Більшість органічних сполук теж являють собою молекулярні кристали (нафталін, цукор, глюкоза).
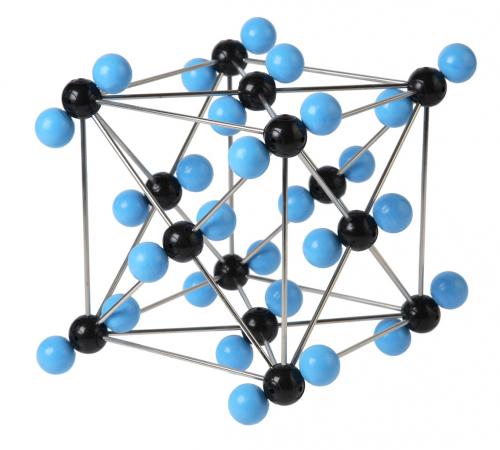
Кристалічна ґратка вуглекислого газу

«Сухий лід»

Кришталики йоду