Молекули фенолу містять бензенове ядро (як арени) та гідроксильну групу (як спирти), отже, він має виявляти властивості як аренів, так і спиртів.
1. Взаємодія з лужними металами.
Феноли виявляють кислотні властивості і за звичайних умов взаємодіють з активними металами. Реакція відбувається так само, як і у спиртів: атоми металічних елементів заміщують атоми Гідрогену гідроксильної групи:
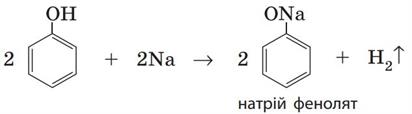
2. Взаємодія з лугами.
Феноли виявляють сильніші кислотні властивості, ніж спирти, і на відміну від них взаємодіють з лугами:
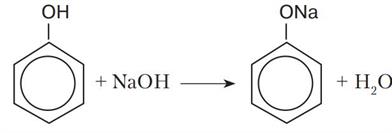
Здатність фенолу взаємодіяти з лугами зумовлена впливом бензенового ядра на зв'язок у гідроксильній групі. Завдяки цьому впливу зв'язок більш полярний, ніж у спиртах, і легше розривається. Унаслідок цього фенол хоч і незначною мірою, але дисоціює у водному розчині:
Але кислотні властивості фенолу настільки слабкі, що навіть така слабка кислота, як карбонатна, витісняє фенол із розчину його солей:
3. Взаємодія з бромом.
Фенол активно взаємодіє з бромом. Під час змішування розчину фенолу з бромною водою за звичайних умов утворюється нерозчинний білий осад \(2\),\(4\),\(6\)-трибромофенолу:
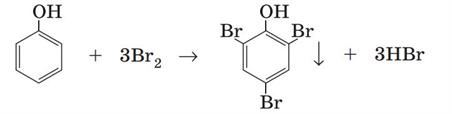
Реакцію з бромом використовують для виявлення фенолу в розчині — це якісна реакція на фенол. Ця хімічна властивість фенолу характеризує вплив гідроксильної групи на бензенове ядро. Бензен взаємодіє з бромом за досить жорстких умов. Якщо в молекулі бензену замістити атом Гідрогену не групу , то реакційна здатність бензенового ядра суттєво зростає: у фенолу хімічна активність набагато вища за бензен. Хімічні реакції заміщення атомів Гідрогену в бензеновому ядрі фенолу відбуваються набагато активніше. Зокрема, фенол бромується за звичайних умов навіть з розчином брому (бромною водою) із заміщенням одразу трьох атомів Гідрогену в бензеновому ядрі.
4. Реакція нітрування.
Як і бензен, фенол піддається нітруванню дією нітратної кислоти. Але, на відміну від бензену, реакція відбувається навіть за звичайних умов або за незначного нагрівання із заміщенням трьох атомів Гідрогену в бензеновому ядрі:
Продукт повного нітрування фенолу — \(2\),\(4\),\(6\)-тринітрофенол — жовта кристалічна речовина, інша її назва — пікринова кислота. Цю кислоту спочатку використовували як жовтий барвник для вовни та шовку, а потім виявили її вибухові властивості й до Другої світової війни використовували для виготовлення боєприпасів. Сьогодні пікринову кислоту застосовують у криміналістичній практиці для виявлення деяких наркотичних речовин.
Джерела:
Хімія (рівень стандарту): підруч. для 10 кл. закл. зак. серед. освіти / М.М. Савчин. — Київ: Грамота, 2018. с. 71-72.
Джерела:
Хімія (рівень стандарту): підруч. для 10 класу закл. загал. серед. освіти / О.В. Григорович. — Харків: Ранок, 2018. с. 105-106.